Los microporos abren camino a la investigación de infecciones
_1763369329.JPG)
Una nueva tecnología permite crear entornos de órganos-en-chip más realistas, permitiendo un mejor transporte de células y partículas que simulan microorganismos
Un nuevo estudio ofrece una forma poderosa de estudiar infecciones en entornos que imitan de manera muy cercana los órganos humanos. La estrategia, probada en un modelo de médula ósea-en-chip, fue desarrollada por personal investigador del Instituto de Salud Global de Barcelona (ISGlobal), el Instituto Germans Trias i Pujol (IGTP), el Instituto de Investigaçao e Innovaçao em Saúde (I3S) de la Universidad de Porto, y el Instituto de Nanocienca y Nanotecnología de la Universidad de Barcelona (IN2UB), como parte del proyecto HIDDENVIVAX financiado por la Fundación "la Caixa".
Algunas enfermedades infecciosas, como la malaria, la leishmaniasis o el VIH, establecen infecciones crónicas y latentes en zonas del cuerpo muy difíciles de alcanzar y estudiar, como la médula ósea. Estos reservorios ocultos permiten que el patógeno evada las respuestas inmunitarias y los tratamientos farmacológicos. También dificultan que los científicos observen directamente lo que ocurre en los pacientes, tanto por razones técnicas como éticas.
Para superar este desafío, la comunidad científica recurre cada vez más a la tecnología de "órgano-en-chip": pequeños dispositivos en los que se cultivan células humanas para imitar la estructura y el comportamiento de los órganos en el laboratorio. Estos chips suelen contener geles que reproducen el entorno tridimensional de nuestros tejidos. "Sin embargo, muchos de estos geles son demasiado densos, lo que dificulta el paso de microbios y células inmunitarias, y el movimiento es esencial para recrear cómo se desarrollan realmente las infecciones", explica el investigador ICREA Hernando del Portillo, quien dirige el grupo 'Plasmodium vivax y exosomas' (PvREX) y lideró el estudio junto con Aurora Hernández-Machado, del grupo de Física de la Materia Condensada de la Universidad de Barcelona, y Cristina Barrias, del Instituto I3S de la Universidad de Oporto.
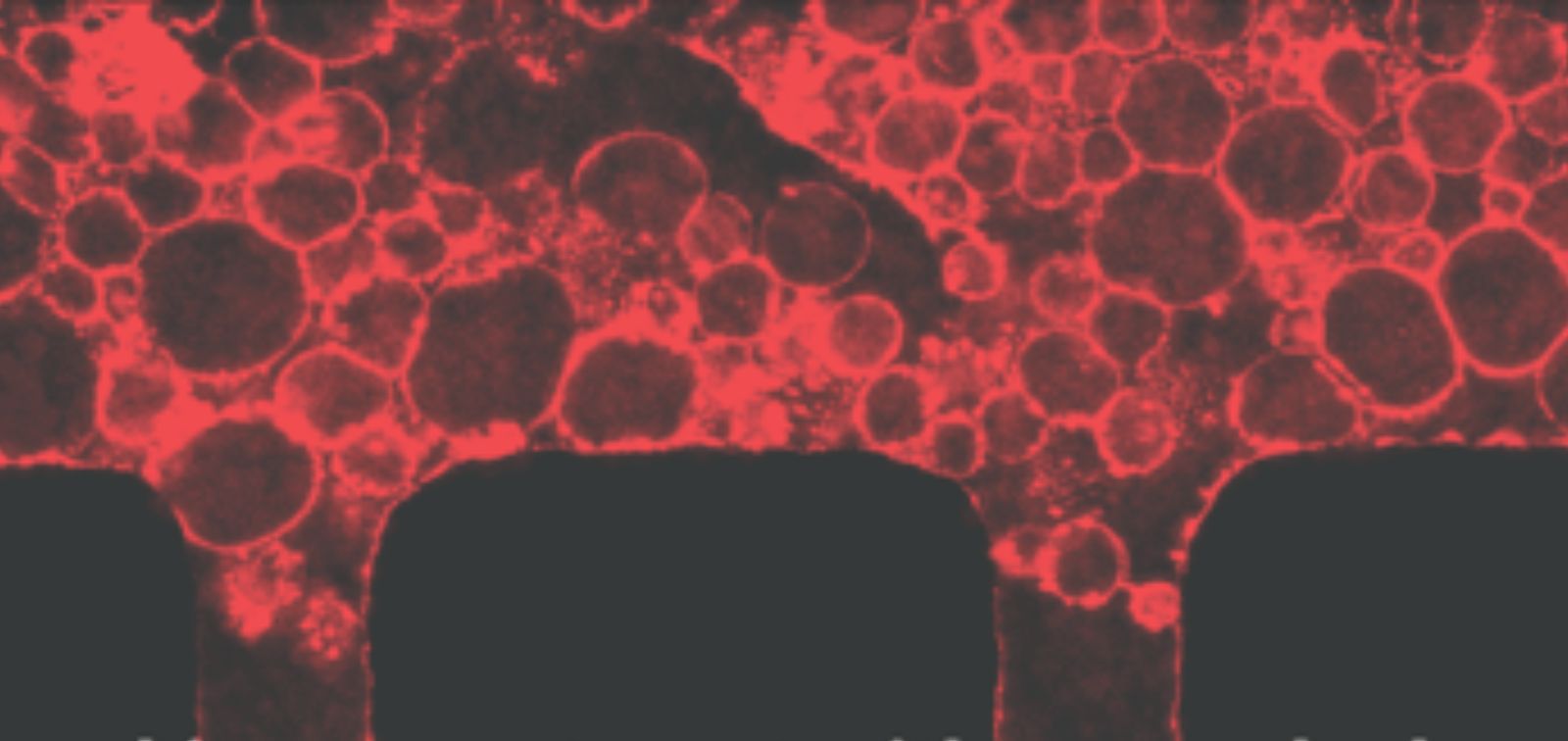
Mejor crecimiento, organización y movimiento
En este estudio, el equipo desarrolló un nuevo tipo de gel poroso que resuelve este problema. Mezclaron pequeñas partículas de alginato removibles en el gel; una vez que el gel se solidificó, disolvieron estas partículas, dejando una red de poros diminutos e interconectados. "Esto facilita enormemente que las células -y los microorganismos- se desplacen a través del gel", comenta la coautora Carmen Fernández-Becerra, investigadora en ISGlobal e IGTP.
Cuando se probó en un modelo de médula ósea-en-chip, el nuevo material permitió un mejor crecimiento y organización de los distintos tipos de células de la médula ósea. También favoreció la formación de estructuras similares a vasos sanguíneos, permitiendo un flujo más eficiente de fluidos y partículas que simulan micoorganismos.
"Los microgeles de alginato utilizados aquí permiten diseñar de forma reproducible sistemas que modelan fielmente los procesos de infección", afirma Hernando del Portillo. Además, estos sistemas pueden ayudar a reducir la necesidad de estudios en animales.
Esta estrategia, que se puede aplicar a diferentes tipos de sistemas de órganos-en-chip, ofrece una valiosa herramienta para modelar enfermedades, estudiar las interacciones huésped-patógeno y explorar intervenciones terapéuticas.
Referencia
Caires HR, Fernández-Castillo O, Sima N et al. Advancing Organ-on-Chip Models With a Sacrificial Granular Hydrogel Strategy for Enhanced Permeability and Biomimicry. Small Methods 2025, e00652. DOI: 10.1002/smtd.202500652
